Audit Medizintechnik
Wie Ihnen als Medizintechnik-Qualitätsmanager vom Management endlich zugehört wird
… damit Sie Ihren Job im QM / Regulatory Affairs endlich wieder richtig machen können.
Sie sehen gerade einen Platzhalterinhalt von Vimeo. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden. Mehr Informationen
Erhalten Sie ein klares, und von externen Experten bestätigtes Bild von den aktuellen Herausforderungen in der QM Ihres Unternehmens
Über 70 Jahre Berater-Erfahrung.

SIE GEBEN IHR BESTES!
im Unternehmen
Als Mitarbeiter in der Qualitätssicherung kennen Sie die Situation: es gibt interne Probleme, die Sie sehen und lösen wollen. Aber niemand im Management scheint Ihnen zuzuhören oder diese Probleme ernst zu nehmen.
Die Gute Nachricht? Wir wissen was Sie brauchen.
Sie brauchen einen externen Unterstützer, der dem Management durch eine Auditierung klar vermittelt, wie die aktuelle Lage ist, sowie was – und dass ein Problem gelöst werden muss.
Unsere Berater sind Ihr qualifizierter Gesprächspartner der versteht, was Ihre Leiden sind, aber gleichzeitig auch Sparringspartner ist mit dem Sie das gemeinsam angehen können.
Auf die Frage: “Hast du schonmal Kunden gehabt die Problem X hatten, und das gelöst haben?” – können wir Ihnen immer mit Erfahrungswissen und Best-Practices aus vergangenen QM-Projekten antworten, sodass eines sicher ist:
Ihr Qualitätsmanagement kommt wieder in die Spur!
Bestandteile eines internen Audits
Wir besprechen die Liste mit allen offenen Punkten und schlagen Ihnen einen von uns individuell angepassten Maßnahmenkatalog vor, der Sie und Ihre Organisation Schritt für Schritt ans Ziel bringt
Wir analysieren Ihr gesamtes Qualitäts-Management-System

Warum ein Audit sinnvoll für Sie ist
Das Audit prüft, ob Ihre Prozesse und Produkte den geltenden Normen und Vorschriften entsprechen und trägt zum anderen dazu bei, dass die Qualität Ihrer Produkten und Prozessen verbessert wird.
Ein Audit anhand dieser Regularien und Normen können wir für sie durchführen
ISO 13485
Die ISO 13485 ist eine Norm, welche Anforderungen an ein Qualitätsmanagementsystem für Medizinprodukt-Hersteller definiert. Im Kern soll das Ziel verfolgt werden, sichere und funktionstaugliche Produkte zu entwickeln.
EU MDR (2017/745)
Die europäische MDR (Medical Device Regulation)müssen Hersteller beachten, die Medizinprodukte in der EU in den Verkehr bringen wollen. Alle Medizinprodukte müssen eine eindeutige Identifizierung erhalten, die UDI (Unique Device Identification). Damit müssen die Produkte in der EUDAMED (European Database on Medical Devices) registriert werden. Die MDR legt Anforderungen an die Gebrauchsanweisung, weitere Begleitmaterialien und das sonstige Labeling wie Aufdrucke und Verpackungen genau fest.
EU IVDR (2017/746)
Die IVDR (In-vitro Diagnostika Regulation) fordert von den Herstellern klinische Studien zur Leistung und den Nachweis, dass Sicherheit und Performance der Produkte für die jeweilige Risikoklasse des Produkts angemessen sind.
MDSAP
Das MDSAP (Medical Device Single Audit Program) ist eine definierte Vorgehensweise, welche die 5 initial teilnehmenden Staaten (USA, Kanada, Brasilien, Japan und Australien) ausgearbeitet und vereinbart haben, um harmonisierte Vorgehensweisen bei Inspektionen durch ihre Behörden und Audits durch zugelassene Zertifizierungsstellen sicherzustellen. Eine „MDSAP Zertifizierung“ vereinfacht den Eintritt mit Produkten in die genannten Märkte und wird in der Regel durch die jeweiligen Länder, ohne eine zusätzliche Inspektion durch ihre verantwortliche Behörde, als ausreichend akzeptiert. Weitere Länder haben sich mittlerweile diesem Auditsystem angeschlossen bzw. akzeptieren Diese. Innerhalb der EU wird eine ausschließliche MDSAP Auditierung nicht als hinreichend akzeptiert.
MDSAP baut auf die ISO 13485:2016 auf und wird durch länderspezifische Anforderungen ergänzt. Weitere Informationen und Guidance-Dokumente zu MDSAP sind kostenlos erhältlich über die Homepage der U.S. Food and Drug Administration (FDA).
QSR (21CFR…)
Die QSR820 ist eine FDA-Verordnung, die die Anforderungen an das Qualitätsmanagementsystem von Medizinprodukteherstellern definiert. Die Verordnung legt fest, dass Medizinproduktehersteller ein Qualitätsmanagementsystem etablieren, implementieren und aufrechterhalten müssen, um sicherzustellen, dass ihre Produkte sicher und wirksam sind. Die neue Verordnung QMSR wurde durch die FDA veröffentlicht und wird verbindlich in 2026.
ISO 14971
Die Norm ISO 14971 bezieht sich hauptsächlich auf das Risikomanagement für Patienten, Anwender sowie weitere beteiligte Personen, Ausstattungen und die Umwelt. Sie legt fest, wie Medizinproduktehersteller verfahren müssen, um mögliche Gefährdungen festzustellen, die mit den Gefährdungen verbunden Risiken eingeschätzt und bewertet werden, und sie prüft wie wirksam Maßnahmen sind, die zur Risikobeherrschung herangezogen werden.
Deshalb wir!
- Sie erhalten nicht nur die Prüfung Ihres Status-Quo, sondern auch einen Maßnahmenplan um die Zertifizierung zu erlangen
- Wir unterstützen Sie in jeder Hinsicht um für und mit Ihnen nachhaltige Lösungen zu finden
- Sie profitieren von langjähriger Erfahrung in verschiedensten Organisationen und Best-Practices zu nahezu jeder QM-Problemstellung

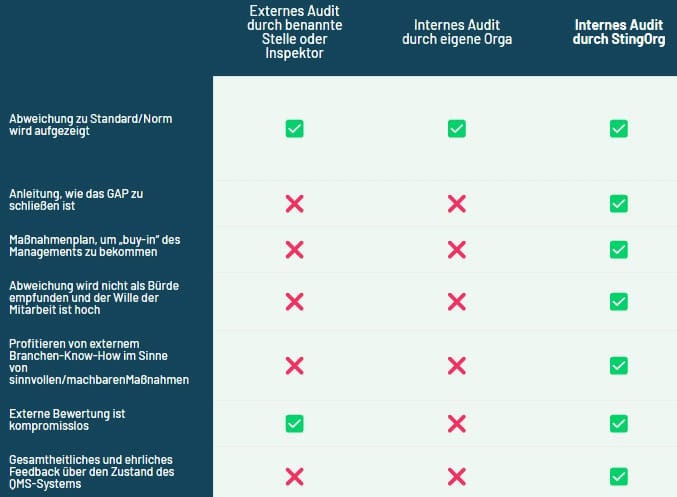
Vorteile eines internen Audits:
Endlich konsequente Qualitätssicherung
Fragen Sie einen Berater, keine Suchmaschine
Was ist Ihre aktuelle Herausforderung in der Qualitätssicherung?
Stellen Sie uns eine Frage – wir antworten Ihnen umgehend!
*Pflichtfelder
Möchten Sie Ihr
Unternehmen voranbringen?
Lassen Sie uns die ersten Schritte gemeinsam gehen!

